Причини за лекарствената резистентност
Когато става дума за лечение с прицелни противотуморни медикаменти, основна причина за лекарствена резистентност е наличието на туморни клетки с мутация различна от тази за която са създадени съответните медикаменти. Напр. за иматиниб се знае, че има най-добро действие върху туморни клетки на ГИСТ с мутация в генът c-kit – екзон 11 и въздейства по-слабо върху такива с мутация в c-kit – екзон 9. Такава информация съществува за всички лекарства от този вид, нарича се предиктивен фактор. Тези данни са плод на редица изследвания както в лабораторни условия, така и върху пациенти. Затова, при първична резистентност на пациенти с ГИСТ към иматиниб и/или сунитиниб е добре да помисли за повторни хистологични и имунохистологични изследвания, т.е. предполага се погрешна диагноза. Определянето на тези медикаменти като прицелни не е случайно – за тях се очакват да въздействат на определени генни дефекти още при синтезирането им. Това е дълъг и труден процес, понякога продължаващ повече от 10 години. Синтезират се безброй нови молекули, многократно се тестват върху различни биологични проби, докато евентуално някой ден се постигне добър антитуморен ефект.
Логично е да се запитаме, защо тогава има лекарствена резистентност, след като иматиниб и сунитиниб са така създадени, че да въздействат на почти всички мутации при ГИСТ?
Една от причините за лекарствена резистентност при лечение на ГИСТ с иматиниб би могло да бъде по-бързото усвояване на медикамента от организма. В този случай, дори не става дума за резистентност, а по-скоро за недостатъчно висока терапевтична доза. Дали това е така, може да се прецени с лабораторни тестове за плазмените нива иматиниб. В България този тест не е част от стандартите за проследяване на лечението, но специалист и апаратура има в Александровска болница – Централна лаборатория по терапевтичен лекарствен мониторинг и клинична фармакология. Дори и да не направите това изследване, обикновено при прогресия на болестта, онколозите преминават към лечение с по-висока доза иматиниб и, ако вашият случай е такъв, то следващият скенер ще покаже стабилизиране на заболяването. Друг индикатор за недостатъчно висока доза иматиниб може да бъде бавното „събуждане” на тумора – слаба активност, бавно нарастване на размера. Оценяването на тези особености е трудно и изисква много познания и опит от страна на онколога.
Много по-честа причина за вторична лекарствена резистентност е наличието на вторични, различни от първоначално откритите мутации в туморните клетки на ГИСТ. Те са един вид следствие от лечението с иматиниб – лекарството блокира туморния растеж и туморът започва да търси начини за да се измъкне от този контрол. Успява, като създава нови мутации, неподаващи се на въздействие от медикамента. За щастие, една част от тях могат да се контролират от сунитиниб, но други не. Освен това, почти винаги при анализ на резистентни към лечение с иматиниб и сунитиниб тумори се откриват повече от 1 вид вторични мутации. Терапията със сунитиниб ще покрие някои от тях, но други няма да може и болестта, макар и бавно, ще напредва.
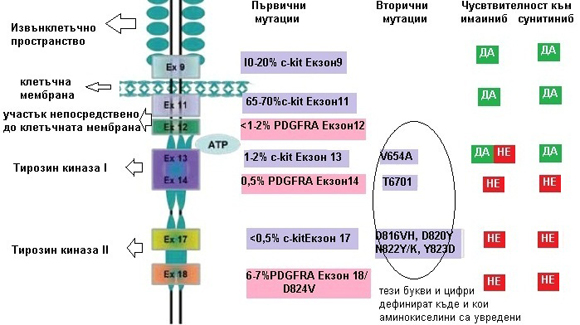 |
|---|
На схемата тук са дадени първичните и някои от по-честите вторични мутации при ГИСТ и ефективността на иматиниб и сунитиниб върху тях. |
----------------------------------------------------
KIT oncogenic signaling mechanisms in imatinib-resistant gastrointestinal stromal tumor: PI3-kinase/AKT is a crucial survival pathway. - Bauer S, Duensing A, Demetri GD, Fletcher JA; Molecular research directions in the management of gastrointestinal stromal tumors . - Tarn C, Godwin AK
